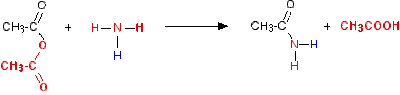
Keasaman
dari suatu asam karboksilat yang gugus fungsi pengionnya sama memiliki tingkat
keasaman yang berbeda-beda. Hal ini dilihat berdasarkan dari gugus lain yang
melekat pada molekul. Contohnya, Ka asam asetat jauh lebih kecil
dibandingkan dengan Ka pada asam mono, di, dan trikloroasetat.
Dimana diketahui tetapan ionisasinya:
Asam
Ka PKa
Asam
asetat 1,8
x 10-5 4,74
Asam
kloroasetat 1,5
x 10-3 2,82
Asam
dikloroasetat 5,0
x 10-2 1,30
Asam
trikloroasetat 2,0
x 10-1 0,70
Dapat
dilihat bahwa keasaman dari asam astetat berbeda sampai 10.000 kali.
Faktor
paling penting yang bekerja disini adalah efek induktif dari gugus yang dekat
dengan gugus karboksil. Efek ini terpancar melalui ikatan, dengan menggeser
elektron ikatan ke arah atom elektronegatif, atau menjauhi atom elektropositif.
Ingat bahwa gugus penarik elektron
meningkatkan keasaman, dan gugus pelepas
elektron menurunkan keasaman.
Hal
ini dikarenakan klorin lebih elektronegatif dibandingkan karbon sehingga ikatan
C-Cl terpolarisasi dengan klorin membawa muatan negatif parsial dan karbon
posiitif parsial. Jadi, elektron tertatik menjauhi ujung ion karboksilat ke
arah klorin. Efek ini cenderung menyebarkan muatan negatif pada ataom yang lebi
banyak dibandingkan pada ion astetat sendiri dan dengan demikian menstabilkan
ion yang bersangkutan. Sehingga semakin banyak klorin, semakin besar efek dan
semakin besar kekuatan asam.
Sehingga
dapat diambil kesimpulan bahwa adanya gugus lain yang melekat pada molekul asam
karboksilat dapat mempengaruhi tingkat keasaman.
Permasalahan:
Berdasarkan
uraian artikel diatas mengenai adanya gugus lain yang melekat pada asam karboksilat dapat mempengaruhi keasaman
karboksilat,
Dapat
dilihat harga pKa untuk
beberapa asam benzoat
Asam
|
Posisi Substitusi dan pKa
|
||
Orto
|
Meta
|
Para
|
|
Asam benzoat
|
4,2
|
4,2
|
4,2
|
Metilbenzoat
|
3,9
|
4,3
|
4,4
|
Hidroksibenzoat
|
3,0
|
4,1
|
4,4
|
Bromobenzoat
|
2,9
|
3,8
|
4,0
|
Klorobenzoat
|
2,9
|
3,8
|
4,0
|
Dari data pKa diatas dapat dilihat bahwa p-hidroksibenzoat memiliki tingkat keasaman yang lebih rendah dari asam benzoat.