Anhidrida merupakan
salah satu turunan asam karboksilat, sehingga dapat disebut juga dengan
anhidrida asam karboksilat. Suatu anhidrida mempunyai struktur dua molekul asam
karboksilat yang digabung menjadi satu dengan melepaskan air.
Pada pembentukan asam
anhidirda ini tidak dapat dibentuk langsung dari asam karboksilat induknya,
melainkan harus dibuat dari derivat asam karboksilat yang lebih reaktif. Salah satunya
adalah dari klorida asam dan suatu karboksilat. Jalan lain untuk menjadi anhidrida adalah dengan mengolah asam
karboksilat dan anhidrida asam asetat.
Anhidrida lebih reaktif
daripada asam karboksilat dan dapat digunakan untuk mensintesis keton, ester
atau amida. Anhidrida asam bereaksi dengan nukleofil yang sama seperti yang
bereaksi dengan, namun laju reaksinya lebih rendah.
Anhidrida bereaksi dengan air untuk menghasilkan
asam karboksilat. Laju reaksinya tergantung pada kelarutan anhidrida dalam air.
Sifat-Sifat Fisik Anhidrida Asam
Untuk menjelaskan sifat-sifat anhidrida asam, maka diambil contoh etanoat sebagai anhidrida asam sederhana.
Kenampakan
Anhidrida etanoat merupakan cairan yang tidak berwana dengan bau yang sangat mirip dengan asam cuka (asam etanoat)
Bau ini timbul karena anhidrida etanoat beraksi dengan uap air diudara (dan kelembapan dalam hidung) menghasilkan asam etanoat kembali.
Kewlautan dalam Air
Anhidrida etanoat tidak bisa dikatakan larut dalam air karena dia bereaksi dengan air menghasilkan asam etanoat. Tidak ada larutan cair dari anhidrida etanoat yang terbentuk.
Titij Didih
Anhidrida etanoat mendidih pada suhu 140 derajat C. Titik didih cukup tinggi karena memiliki molekl polar cukup besar sehingga memiliki gaya dispersi Van der Waals sekaligus gaya tarik dipol-dipol.
Akan tetapi, anhidirda etanoat tidak membentuk ikatan hidrogen. ini berarti bahwa titik didihnya tidak sama tingginya dengan titik didih asam karboksilat yang berukuran sam. Sebagai contoh, asam pentanoat (asam yang paling mirip besarnya dengan anhidrida etanoat0 mendidih pada suhu 186 derajat C.
Kereaktifan Anhidrida Asam
Perbandingan Anhidrida Asam dengan Asil Klorida
Anhidrida bisa dianggap sebagai asil klorida yang termodifikasi. memahami anhidrida asam akan jauh lebih mudah jika mengaggapnya seolah-olah asil klorida yang termasuk yang termasuk dibanding jika dipelajari seacara terpisah.
Bandingan dengan anhidirda asam dengan struktur asil klorida:
Sifat-Sifat Fisik Anhidrida Asam
Untuk menjelaskan sifat-sifat anhidrida asam, maka diambil contoh etanoat sebagai anhidrida asam sederhana.
Kenampakan
Anhidrida etanoat merupakan cairan yang tidak berwana dengan bau yang sangat mirip dengan asam cuka (asam etanoat)
Bau ini timbul karena anhidrida etanoat beraksi dengan uap air diudara (dan kelembapan dalam hidung) menghasilkan asam etanoat kembali.
Kewlautan dalam Air
Anhidrida etanoat tidak bisa dikatakan larut dalam air karena dia bereaksi dengan air menghasilkan asam etanoat. Tidak ada larutan cair dari anhidrida etanoat yang terbentuk.
Titij Didih
Anhidrida etanoat mendidih pada suhu 140 derajat C. Titik didih cukup tinggi karena memiliki molekl polar cukup besar sehingga memiliki gaya dispersi Van der Waals sekaligus gaya tarik dipol-dipol.
Akan tetapi, anhidirda etanoat tidak membentuk ikatan hidrogen. ini berarti bahwa titik didihnya tidak sama tingginya dengan titik didih asam karboksilat yang berukuran sam. Sebagai contoh, asam pentanoat (asam yang paling mirip besarnya dengan anhidrida etanoat0 mendidih pada suhu 186 derajat C.
Kereaktifan Anhidrida Asam
Perbandingan Anhidrida Asam dengan Asil Klorida
Anhidrida bisa dianggap sebagai asil klorida yang termodifikasi. memahami anhidrida asam akan jauh lebih mudah jika mengaggapnya seolah-olah asil klorida yang termasuk yang termasuk dibanding jika dipelajari seacara terpisah.
Bandingan dengan anhidirda asam dengan struktur asil klorida:
Dalam reaksi anhidrida etanoat, gugus yang berwarna merah tersebut selalu tetap dalam keadaan utuh. Gugus ini seolah-olah mnerupakan sebuah atom tunggal- persis seperti atom klorida pada asil klorida.
Reaksi yang umum terjadi pada asil klorida adalah penggantian klorin dengan sesuatu yang lain.
Dengan mengambil contoh klorida etanoil sebagai asil klorida sederhana, reaksi awal yang terjadi adalah:
Gas hidrogen klorida dihasilkan, walaupun gas ini bisa bereaksi kembali dengan komponen-komponen lain dalam campuran. denagn anhidirda asam, reaksi berlangsung lambat, tetapi satu-satunya perbedaan esensial adalah bahwa yang dihasilkan bukan hidorgen klorida sebagai produk lain, tetapi asam etanoat.
Seperti halnya dengan hidrogen klorida, produk ini (assam etanoat) juga bisa bereaksi kembali dengan komponen lain yang adda dalam campuran.
Reaksi-reaksi ini (reaksi asil kloorida an reaski anhidirda asam) melibatkan komponen seperti air, alkohol dan fenol, atau amonia dan amina. Semua komponen ini mengandung unsur yang sangat elektronegatif dengan sebuah pasangan elelktron bebas yang aktif, baik oksigen maupun nitrogen.
Reaksi-reaksi ini (reaksi asil kloorida an reaski anhidirda asam) melibatkan komponen seperti air, alkohol dan fenol, atau amonia dan amina. Semua komponen ini mengandung unsur yang sangat elektronegatif dengan sebuah pasangan elelktron bebas yang aktif, baik oksigen maupun nitrogen.
REAKSI-REAKSI ASAM
ANHIDRIDA
Reaksi dengan Alkohol
dan Fenol
Reaksi asam anhidrida
dengan alkohol atau fenol, dengan bantuan katalis akan menghasilkan ester. Reaksi
ini terutama berguna dengan anhidrida asam asetat yang tersedia secara
komersial. Contohnya seperti pada pembentukan aspirin, yaitu dengan mereaksikan
asam anhidrida dengan asam salisilat dengan menggunakan katalis H3PO4
sebagai penghidrasi. Asam salisilat adalah asam bifungsional yang mengandung
dua gugus –OH dan –COOH. Sehingga asam salisilat ini dapat mengalami dua jenis
rekasi yang berbeda yaitu reaksi asam dan basa. Reaksi dengan anhidrida asam
asetat akan menghasilkan aspirin.
Anhidrida asam asetat
yang digunakan karena hasil esterifikasi fenol ini akan mendapatkan hasil yang
lebih baik apabila digunakan derivat asam karboksilat yang lebih reaktif. Anhidrida
asam merupakan derivat yang lebih
reaktif daripada asam karboksilat yang dapat menghasilkan ester asetat.
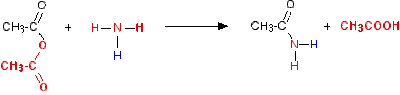
Reaksi dengan Amonia dan
Amina Primer
Amonia, amina primer,
dan amina sekunder bereaksi dengan amhidirida menghasilkan amida. Amonia dan
anhidrida asetat menghailkan asetamida, sedangkan amina dan anhidrida asam
asetat menghasilkan asetamida tersubtitusi. Satu mol amina dihabiskan dalam
netralisasi asetat yang terbentuk dalam reaksi itu.
Persamaan ini lebih sering dan Lebih mudah dituliskan sebagai berikut:
Asam
etanoat yang dihasilkan bereaksi dengan amonia berlebih menghasilkan amonium
etanoat.
dan bisa digabungkan kedua reaksi ini menghasilkan
satu reaksi lengkap:
Reaksi dengan Amina Primer
Reaksi dengan Metilamin
Kita akan mengambil contoh metilamin sebagai amina primer sederhana dimana gugus _NH2 terikat pada sebuah gugus alkil. Persamaan awaknya adalah sebagai berikut:
Pada reaksi ini, produk utama disebut sebagai amida yang tersubtitusi-N.
Jika dibandingan strukturnya dengan amida yang dihsilkan pada reaksi dengan amonia, yang membedakann adalah bahwa salah satu hidrogen pada nitrogen telah di subtitusikan dengan sebuah gugus metil. senyawa ini adalah N-metiletanamida "N" menunjukkan bahwa subtitusi terjadi pada atom nitrogen, dan bukan pada unsur lain dlaam molekul tersebut.
Persamaannya biasa dituliskan sebagai berkut:
Ini bisa dianggap amina primer sebagai amonia yang termodifikasi. Jika amonia adalah
basa dan membentuk sebuah garam dengan asam etanoat, maka metilamin yang
berlebih juga akan mengalami hal yang sama. Reaksinya sebagai berikut:
Garam yang terbentuk disebut metilamonium etanoat. Garam ini persis sama seperti amonium etanoat, kecuali bahwa ssalah satu hidrogen telah digantikan oleh sebuah gugus metil.
Kedua persamaan reaksi diatas digabungkan menjadi satu persamaan lengkap yaitu:
Reaksi dengan fenilamin
(anilin)
Fenilamin adalah amina primer yang
paling sederhana dimana gugus -NH2 terikat
secara langsung pada sebuah cincin benzen. Nama lamanya adalah anilin.
Pada fenilamin, hanya gugus -NH2 yang terikat pada cncin. Rumus struktur
fenilamin bisa dituliskan sebagai C6H5NH2.
Tidak ada perbedaan esensial antara reaksi ini dengan
reaksi dengan metilamin, tetapi terbentuknya struktur amida yang
tersubstitusi-N perlu dipahami.
Persamaan reaksi lengkapnya adalah sebagai berikut:
Produk yang terbentuk adalah N-feniletanamida dan
fenilamonium etanoat.
Reaksi ini terkadang terlihat lebih rumit jika
fenilamin digambarkan dengan memperlihatkan cincin benzennya, dan khususnya
jika reaksi dijelaskan dari sudut pandang fenilamin.
Sebagai contoh, molekul produk bisa digambarkan
sebagai berikut:
Jika dicermati, molekul ini persis sama
seperti molekul pada persamaan di atas, hanya saja lebih menekankan bagian
fenilamin dari molekul tersebut.
Amati molekul ini dalam bentuk yang
memperlihatkan cincin benzennya, perhatikan bahwa salah satu hidrogen dari
gugus -NH2 telah digantikan oleh sebuah gugus asil
(sebuah gugus alkil yang terikat pada sebuah ikatan rangkap C=O). Bisa dikatakan bahwa fenilamin
telah terasilasi atau telah mengalami asilasi. Karena sifat dari gugus alkil yang khusus ini, maka
proses ini juga disebut sebagai etanoilasi.
Hidrogen digantikan oleh sebuah gugus etanoil, CH3CO-.
Masalah:
Dari artikel diatas
disebutkan bahwa hasil reaksi pembentukan aspirin akan menghasilkan produk yang lebih baik jika di gunakan turunan asam karboksilat yang lebih reaktif. Maka pertanyaannya
adalah bagaimana jika asam anhidrida di ganti dengan turunan asam karboksilat yang lain seperti asil klorida, dimana diketahui kereaktifaannya lebih jika dibandingkan dengan asam anhidrida? apakah akan menghasilkan aspirin
seperti yang dihasilkan dengan menggunakan anhidrida dan jika bisa apakah
terjadi perubahan sifat dari aspirin tersebut?







Berdasarkan artikel yang saya baca, Aspirin ini dibuat dengan cara esterifikasi, dimana bahan aktif dari aspirin yaitu asam salisitat direaksikan dengan asam asetat anhidrad atau dapat juga direaksikan dengan asam asetat glacial bila asam asetat anhidrad sulit untuk ditemukan. Asam asetat anhidrad ini dapat digantikan dengan asam asetat glacial karena asam asetat glacial ini bersifat murni dan tidak mengandung air selain itu asam asetat anhidrad juga terbuat dari dua asan asetat galsial sehingga pada pereaksian volumenya semua digandakan. Pada proses pembuatan reaksi esterifikasi ini dibantu oleh suatu katalis asam untuk mempercepat reaksi. Tetapi pada penambahan katalis ini tidak terlalu berefek maka dilakukan lah pemanasan untuk mempercepat reaksinya. Pada pembuatan aspirin juga ditambahkan air untuk melakukan rekristalisasi berlangsung cepat dan akan terbentuk endapan. Endapan inilah yang merupakan aspirin.
BalasHapusReaksi yang terjadi adalah reaksi esterifikasi yang merupakan prinsip dari pembuatan aspirin.Aspirin dibuat dengan mereaksikan asam salisilat dengan anhidrida asam asetat menggunakan katalis 85% H3PO4 sebagai zat penghidrasi. Dalam hal ini asam salisilat berperan sebagai alkohol karena mempunyai gugus –OH , sedangkan anhidrida asam asetat tentu saja sebagai anhidrida asam. Ester yang terbentuk adalah asam asetil salisilat (aspirin). Gugus asetil (CH3CO-) berasal dari anhidrida asam asetat, sedangkan gugus R-nya berasal dari asam salisilat (pada gambar di atas gugus R ada di dalam kotak).Reaksi dengan anhidrida asam asetat akan menghasilkan aspirin. Asam asetat anhidrad ini dapat digantikan dengan asam asetat glacial karena asam asetat glacial ini bersifat murni dan tidak mengandung air selain itu asam asetat anhidrad juga terbuat dari dua asan asetat galsial sehingga pada pereaksian volumenya semua digandakan.
BalasHapussemoga bermanfaat :)
jika asam anhidrida di ganti dengan turunan asam karboksilat yang lain seperti asil klorida, maka dapat dibuat aspirin, karena asil klorida mempunyai kereaktifan yang lebih dari pada turunan asam karboksilat yang lain. hal ini dapat diketahui dengan Keberadaan gugus karbonil dalam turunan asam karboksilat sangat menentukan kereaktifan dalam reaksinya, walaupun gugus karbonil tersebut tidak mengalami perubahan.
BalasHapusSaya akan mencoba menjawab pertanyaan anda, pada dasarnya asil klorida bersifat lebih reaktif dari pada asam anhidrida, dan menurut artikel yang saya baca mengenai pembuatan aspirin, dimana pembuatan aspirin ini merupakan salah satu contoh sintesis ester.
BalasHapusDan dalam perindustrian, reaksi kesetimbangan sangatlah merugikan karena produk yang dihasilkan sangatlah sedikit, sehingga dalam mengatasi hal ini, asam anhidrida-lah jalannya. Dan dalam proses pembuatan aspirin yang bereaksi dengan asam anhidrida tidak boleh menggunakan air, karena dapat membuat asam anhidridaa terhidrolisis menjadi 2 mol asam assetat.
Dan jika hal ini terjadi, berarti aspirin yang dihasilkan tidaklah murni lagi. Maka dari itu saya dapat menyimpulkan, dalam pembuatan aspirin lebih baik menggunakan asam anhidrida agar menghasilkan aspirin yang murni.
semoga bermanfaat, :)
saya akan menambhakan sedikit jawaban,
BalasHapusjika di tinjau dari reaksinya, asam salisilat direaksikan dengan anhidrida asam asetat akan menghasilkan aspirin dgn hasil samping asam asetat. asam asetat ini akan terhidrasi menjasi anhidrida asam asetat dan bereaksi kembali dengan asam salisilat membentuk aspirin dgn hasil samping asam asetat pula. Dengan kata lain reaksi akan berhenti ketika asam sulfat yang digunakan sebagai katalis habis.
jika pembuatan aspirin ini diganti dengan menambahkan asil klorida, maka mungkin hasil samping yang dihasilkan adalah asam klorida (HCL). terlebih lagi HCL keasamannya lebih tinggi dibandingkan asam asetat.
semoga dapaat membantu :)
Sy ingin bertanya bahwa dari reaksi di atas dapat dilihat bahwa penyerangan dilakukan oleh gugus OH hidroksil bukan OH pada gugus asam dari asam salisilat. Mengapa demikian?
BalasHapus